Le Stelle Oscure all’alba del Cosmo

Il James Webb Space Telescope è una macchina veramente formidabile, ma un telescopio del genere non viene costruito solo per studiare quello che già sappiamo. Anzi. Il vero scopo di creare qualcosa di così potente è vedere quello che non era possibile osservare prima di esso. L’inaspettato è il succo della Scienza, perché permette di farci nuove domande, e aprire la caccia alle relative risposte. E lo scorso 11 luglio il JWST ha fatto proprio questo: potrebbe aver scoperto una cosa inaspettata e sconosciuta.
Mio Dio, è pieno di galassie
La storia inizia con un’immagine, pubblicata lo scorso dicembre. È una delle immagini più profonde mai realizzate, e si chiama JADES – JWST Advanced Deep Extragalactic Survey. Gli astronomi hanno rivisitato una nostra vecchia conoscenza, lo Hubble Ultra Deep Field (il campo Hubble ultraprofondo), un francobollo di cielo che fu osservato per 11 giorni di fila nel 2004. In quel francobollo apparentemente vuoto si materializzarono oltre 10.000 galassie, tra cui le più lontane mai osservate dall’astronomia.
Un tesoro di informazioni sterminato, che per quasi 20 anni ha dato molte soddisfazioni ai ricercatori, perché ci permette di studiare che aspetto aveva l’Universo appena nato. Era naturale quindi che quest’area di cielo venisse visitata anche da strumenti più potenti, come avvenuto nei 20 anni intercorsi, fino all’arrivo del JWST. Studiare le galassie lontane è proprio uno degli obiettivi scientifici primari del grande telescopio spaziale, pensato e progettato per osservare proprio la radiazione infrarossa proveniente da tali oggetti remoti. Ed ecco quindi che JWST è stato puntato proprio verso lo Hubble UDF, per vedere che trovava.

E meraviglia! Le galassie sono diventate addirittura 100.000! Il campo osservato da NIRCam si sovrappone parzialmente allo Hubble UDF, e copre anche alcune aree circostanti. Gli astronomi si sono quindi messi in caccia degli oggetti più lontani visibili in questa immagine, utilizzando lo spettroscopio di bordo (NIRSpec). Calcolare la distanza di oggetti così remoti non è un compito facile, basato su una proprietà dell’Universo: il fatto che si espande all’impazzata da circa 13,8 miliardi di anni.
Galassie in fuga
Il principio è quello dell’effetto Doppler relativistico. Quando una sorgente di radiazione elettromagnetica (= luce) si avvicina a noi, vediamo la sua luce “compressa” dal moto. Comprimere un’onda significa accorciare lo spazio tra le creste (la lunghezza d’onda), e quindi l’effetto è quello di vedere la luce in arrivo più “azzurra”, spostata verso il blu. Viceversa se la sorgente si allontana, la sua luce sarà “allungata” e spostata verso il rosso. Confrontando la luce ricevuta da ciascuna sorgente con quella che ci aspettiamo di vedere è possibile capire quanto è intenso lo spostamento verso il rosso o il blu (redshift o blueshift). Nel caso di galassie e stelle si cercano i colori a cui assorbono/emettono l’idrogeno e l’elio, due gas perfettamente noti dal laboratorio ed estremamente abbondanti nell’Universo. Dal confronto con i dati di laboratorio è immediato capire quanto è stata “stiracchiata” la luce.
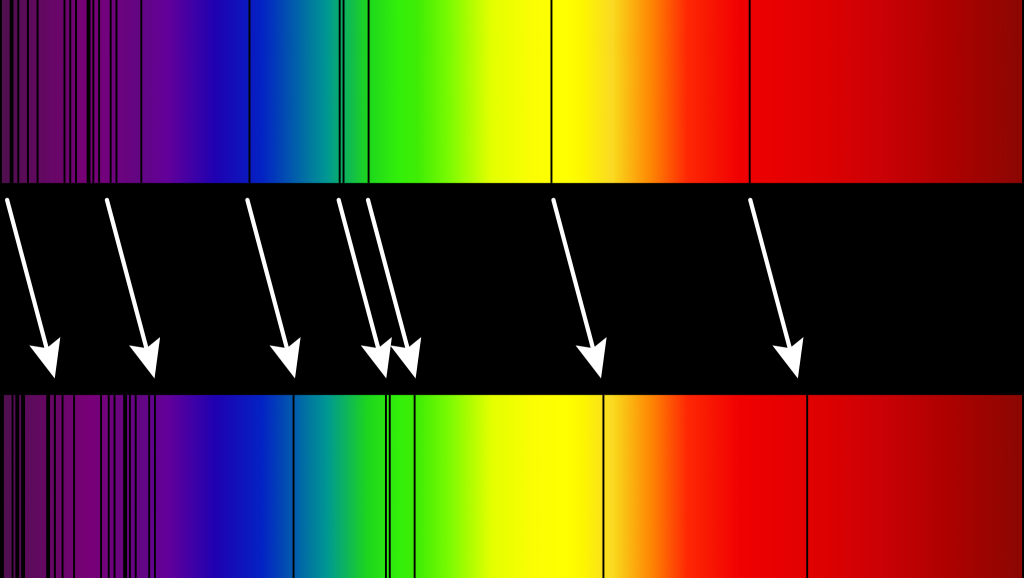
Quest’effetto, noto come redshift cosmologico, ha permesso a Edwin P. Hubble proprio di scoprire l’espansione dell’Universo, e ai cosmologi di formulare per la prima volta l’ipotesi del Big Bang. In astrofisica il redshift di una sorgente viene indicato con la lettera z e indica di quanto è stata allungata/accorciata la lunghezza d’onda (es: un redshift di 2 indica che la lunghezza d’onda è stata raddoppiata). C’è anche una relazione matematica che collega il redshift cosmologico a quanto si è espanso l’Universo nel frattempo: basta aggiungere 1 a z. Cioè, se vediamo una galassia con z=3 allora l’Universo è quadruplicato di dimensioni da quando quella luce è stata prodotta. Se una stella brilla principalmente di luce azzurra (lunghezza d’onda di 400 nanometri) allora un redshift pari a 3 significa che ora quella luce si trova a 1200 nanometri, in pieno infrarosso. È immediato capire perché il JWST è stato pensato proprio per osservare l’infrarosso.

Ecco, nell’immagine JADES ci sono quattro galassie spaventosamente lontane. Il loro redshift ha valori superiori a 10, e in due casi si aggira intorno al 13. Significa che la luce prodotta da questi oggetti è stata allungata di 13 volte, e l’Universo nel frattempo ha aumentato la sua dimensione di un fattore 14. Inserendo questi numeri nelle formule della cosmologia si ottiene che la luce di tali galassie è partita quando l’Universo aveva appena 330 milioni di anni. In pratica, stiamo guardando le prime, vere, galassie e le loro stelle. Quella è la luce che pose fine alle lunghe Epoche Oscure dell’Universo primordiale, quando il Cosmo era popolato solo dal gas in raffreddamento prodotto dal Big Bang, e nient’altro.
L’Universo mancante
La storia però non finisce qua, perché quelle quattro galassiette hanno veramente attirato l’attenzione di tutti gli astronomi. Tra di essi anche Katherine Freese e il suo team, dell’Università del Texas. Nel 2008 Freese ebbe un’idea particolare, insieme al collega Doug Spoyla e Paolo Gondolo: come interagiva la Materia Oscura con le prime stelle primordiali? All’epoca l’Universo era molto piccolo, e tale componente del Cosmo era giocoforza più densa di oggi. Magari a sufficienza perché qualche effetto particolare si affacciasse sulla scena.
La Materia Oscura è sempre la solita storia: vediamo intorno a noi un tot di materia luminosa, ma anche considerando tutto quello che vediamo, fino alle briciole dei neutrini, non riusciamo a spiegare perché le galassie e le stelle si muovono alla velocità misurata. Semplicemente c’è troppa poca materia visibile per mantenere insieme le strutture del Cosmo, a quelle velocità tutto semplicemente dovrebbe disgregarsi sotto l’effetto delle forze centrifughe. E invece palesemente non succede, quindi c’è qualcosa che non capiamo. Ipotesi 1: ci siamo persi della materia per strada. È quella che appunto viene chiamata Materia Oscura, non perché abbia ceduto al lato oscuro della Forza, ma semplicemente perché è una roba invisibile (oscura) che agisce con la sua massa (come la materia). Ipotesi 2: non abbiamo capito niente di gravità, e le equazioni di Albert Einstein sono incomplete. Funzionano a meraviglia ma solo fino a un certo punto, oltre il quale intervengono effetti ancora non compresi e quantificati.

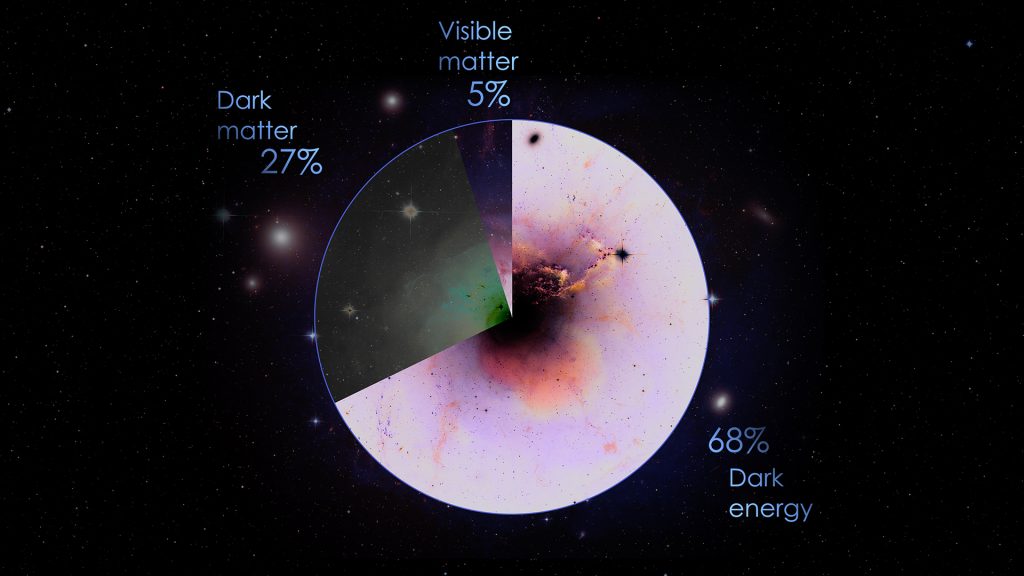
Quale che sia l’ipotesi per cui facciate il tifo, al momento è la numero 1 a tirare maggiormente il carro della ricerca. E siccome una buona dose di Materia Oscura sembra anche spiegare efficacemente come l’Universo si è evoluto dopo il Big Bang (il cosiddetto modello ΛCDM, Lambda-Cold Dark Matter) ecco che i cosmologi tendono a trattarla come qualcosa di assodato. Badate però, al momento resta solo un’ipotesi, e molto di comodo. Secondo le ultime stime, il 25% di tutto quello che è contenuto nel Cosmo è Materia Oscura, a cui vanno aggiunti un 5% di materia ordinaria e addirittura un 70% di una roba ancora più esotica e incomprensibile, l’Energia Oscura. Recentemente è partita una missione per lo studio di queste componenti misteriose: il telescopio spaziale Euclid. Una tale quantità di roba non può essere ignorata se si vuole capire come sono nate stelle e galassie, ed è qui che troviamo l’idea di Freese e colleghi.
Le prime stelle
Per spiegare la nascita di stelle e galassie i cosmologi assumono che sia stata la Materia Oscura la prima ad organizzarsi, formando delle zone più dense intervallate da spazi più vuoti, i cosiddetti aloni. All’interno di ciascun alone si sarebbe quindi andata a concentrare la materia ordinaria, che alla lunga avrebbe raggiunto le densità e temperature critiche per innescare il collasso gravitazionale e quindi la formazione delle primissime stelle.

I modelli prevedono che tali astri, noti come “stelle di popolazione III” fossero dei leviatani di idrogeno ed elio praticamente puri, 1000 volte più massicce del Sole e milioni di volte più luminose. La fine delle Epoche Oscure, la nascita della luce.
Ma chi ha fretta vive poco, e dopo alcuni milioni di anni tali astri morivano catastroficamente, producendo le prime supernovae della Storia. In tale morte sparavano nel Cosmo i prodotti della fusione nucleare, come ossigeno, carbonio, ferro eccetera, fertilizzando il mezzo interstellare e dando il via a una seconda ondata di formazione stellare. Queste stelle ora non erano più fatte di idrogeno ed elio puri, ma avevano dei contaminati: la popolazione II. A loro volta tali stelle morendo fertilizzarono ulteriormente il gas interstellare e causarono la formazione di un’altra generazione stellare: la popolazione I, di cui fa parte anche il Sole. Stelle abbastanza ricche di elementi pesanti da poter possedere una cosa totalmente nuova: i pianeti!
Le quattro galassiette osservate dal JWST all’alba dei Tempi sono le migliori candidate che abbiamo in merito a stelle di popolazione III. È possibile infatti che parte della luce che riceviamo da tali galassie sia ancora prodotta da quelle stelle, che a 330 milioni di anni dall’Inizio erano ormai in declino. A meno che non siano galassie.
Le Stelle Oscure
Nell’ipotesi di Freese e colleghi, infatti, nell’Universo primordiale si produssero sì degli aloni, al cui interno si addensò la materia, ma tale materia ordinaria non era pura: c’era anche della Materia Oscura in mezzo. In tracce, ma presente, perché la Materia Oscura è ovunque. Tra le svariate ipotesi sulla sua natura, molte prevedono che le particelle che compongono la Materia Oscura siano le antiparticelle di sé stesse. Cioè quando due corpuscoli di Materia Oscura si incontrano si annichilano a vicenda, producendo un lampo di luce.
La domanda che si sono fatti Freese, Spoylar e Gondolo era la seguente: possibile che tale emissione di energia da annichilazione possa modificare il comportamento delle nubi di materia primordiale? La risposta a cui approdarono è sì, e significativamente.
In pratica dai calcoli del terzetto emerse che questi aloni producevano radiazione a causa dell’annichilazione della Materia Oscura con sé stessa. Questa fonte di energia impediva alla materia ordinaria di collassare e produrre stelle, permettendo all’alone di crescere sempre di più, accumulando massa dal circondario. Alla fine si ottenevano delle nubi di materia con masse centinaia di migliaia di volte quella del Sole, se non un milione, alla temperatura di 10.000 °C e in grado di brillare con la luce di un miliardo di soli. Come una galassia in pratica.
Freese & Co. chiamarono questi oggetti “Stelle Oscure”. Non perché fossero fatti di Materia Oscura, o perché fossero bui, ma perché erano dei cosi simili a stelle la cui fonte di energia però non era la fusione nucleare, bensì l’annichilazione della Materia Oscura in essi contenuta. Nell’articolo pubblicato lo scorso 11 luglio si avanza proprio questa spiegazione per tre delle quattro galassiette viste dal JWST: sembrano avere tutte le carte in regola per essere le prime Stelle Oscure mai osservate. Non galassie fatte da centinaia di milioni di stelle primordiali, ma singole palle sfocate di gas incandescente riscaldato dalla Materia Oscura.

Quello che è intrigante di tale modello è che risolve un altro bel problema della cosmologia: la nascita dei buchi neri supermassicci. L’astrofisica attuale calcola infatti che oggetti di tale massa (centinaia di milioni, se non miliardi di masse solari) richiedano uno sfacelo di tempo per raggiungere le loro gargantuesche dimensioni partendo da dei semi primordiali non più grandi del Sole. Tali sono infatti i buchi neri prodotti dalle supernovae. Solo che questa cosa non quadra, perché si osservano buchi neri con miliardi di masse solari ad appena un miliardo di anni dalla nascita dell’Universo.
Diversa sarebbe la questione se i semi primordiali avessero una massa di qualche centinaio di migliaia di masse solari. Le Stelle Oscure fanno proprio al caso nostro: hanno già una massa pari a milioni di volte quella solare, e nel momento in cui la loro fonte di energia si esaurisce (perché l’annichilazione della Materia Oscura si fa sempre meno efficiente) ecco che la stella collassa direttamente in un buco nero di massa elevata. Un seme perfetto per generare in poco tempo i buchi neri supermassicci che vediamo attivi nei quasar antichi.
Quale che sia la natura di quei batuffolini di luce, il dibattito è destinato a farsi molto interessante. Serviranno altri dati, e forse strumenti più potenti ancora di JWST, per risolvere il mistero. E questo senza contare che forse la Materia Oscura potrebbe non esistere nemmeno! Prendete dunque questa notizia con la dovuta cautela.