Ormai è storia trita e ritrita: un qualsiasi starnuto da parte degli astronomi che contenga anche solo un frammento della parola “vita” o “abitabile” è sufficiente per far partire la gara al titolone più eclatante sugli alieni. Dopotutto l’indicizzazione funziona così. Ma non sul nostro sito! Ecco quindi tutto quello che c’è veramente da sapere su K2-18 b, un pianeta estremamente interessante individuato appena 10 anni fa.
Un mondo promettente
K2-18 b è il diciottesimo sistema planetario scoperto dalla seconda fase della missione Kepler (detta K2). Quella eseguita con il telescopio “reinventato” dopo che il suo sistema di puntamento rimase con sole due ruote di reazione operative. Al contrario della missione principale, K2 osservava una zona diversa di cielo ogni circa 3 mesi permettendo di esplorare aree aggiuntive rispetto a quanto svolto negli anni precedenti.
Il pianeta risultò interessante fin dalla sua scoperta, nel 2015, per via delle sue caratteristiche fisiche e orbitali. Inizialmente ne conoscevamo solo il raggio, perché Kepler scopriva pianeti osservandoli transitare di fronte alla loro stella. K2-18 b è circa 2,6 volte più grande della Terra, quindi a metà strada tra i pianeti rocciosi come il nostro e i pianeti gassosi come Nettuno e Urano. Il solo raggio però non è sufficiente per trarre delle conclusioni sulla natura del pianeta! Specialmente in questo regime ibrido dove i nostri modelli ci dicono possono trovarsi sia pianeti rocciosi molto grandi (le superterre) sia pianeti gassosi molto piccoli (i mininettuno). A essere particolarmente interessante era però la sua stella e soprattutto la distanza che intercorre tra di essa e il pianeta.
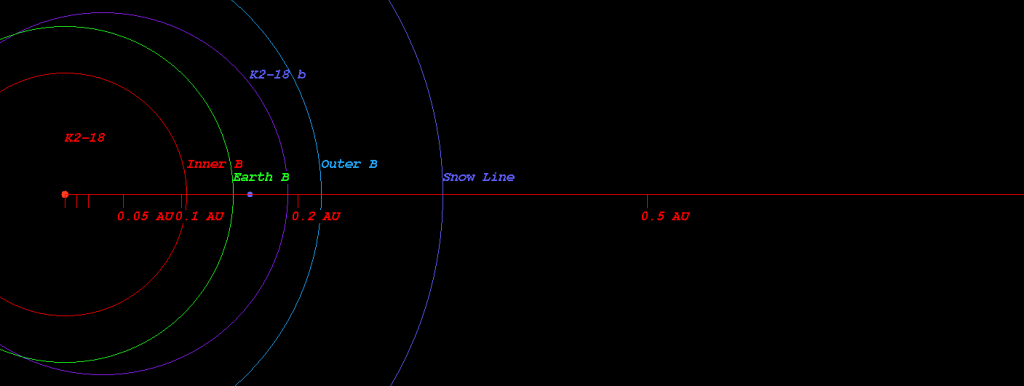
K2-18 b orbita ogni 33 giorni ad appena 24 milioni di km dalla sua stella, molto più vicino della Terra dal Sole. Tuttavia la stella, K2-18, è decisamente più piccola e debole della nostra. Si tratta di una nana rossa, con la metà della massa del Sole e una luminosità appena del 2,3%. I due valori si compensano a vicenda e fanno sì che il pianeta si trovi proprio sul limite interno della cosiddetta fascia abitabile! Detto in soldoni, avevamo trovato un pianeta potenzialmente abitabile (per la vita come la conosciamo) che riceve quasi esattamente la stessa energia che la Terra riceve dal Sole. K2-18 b entrò a pieno titolo tra i pianeti più interessanti da studiare nel contesto della ricerca della vita extraterrestre.
Mondo iceano (sì, con la i)
La prima cosa da fare per dissipare la nebbia che avvolgeva questo mondo a 121 anni luce di distanza dal nostro era misurarne la massa. Ciò fu fatto nel 2017 osservando come la sua presenza spostava avanti e indietro la sua stella, utilizzando lo spettroscopio HARPS presso il telescopio da 3,6 metri di La Silla, in Cile. Il valore ottenuto fu di circa 8,6 volte la massa della Terra. Finalmente era possibile calcolare la densità del pianeta e fare qualche assunzione sulla sua natura. Questa non è cosa da poco, perché spesso conoscere le due informazioni con precisione sufficiente è impossibile.

Crediti: Pablo Carlos Budassi
La densità risultò essere di 2,7 g/cm3, intermedia tra quella della Terra e quella di Nettuno. In pratica, K2-18 b non è un pianeta roccioso, ma non può nemmeno essere un pianeta gassoso, è qualcosa di intermedio. Ci sono tantissime combinazioni di roccia, acqua, gas e composti vari che possono spiegare queste caratteristiche, ma una in particolare attirò l’attenzione degli esoplanetologi: i pianeti iceano. Si tratta di mondi fatti quasi interamente di acqua e avvolti da una spessa atmosfera di idrogeno, da cui la parola inglese hycean, un portmanteau di “hydrogen” e “ocean”.
Sappiamo che le atmosfere ricche di idrogeno non sono un impedimento alla vita, anzi possono pure aiutarla aumentando l’effetto serra e rendendo abitabili pianeti altrimenti troppo freddi. È proprio il caso di K2-18 b, la cui temperatura di equilibrio sarebbe intorno ai -20 °C senza effetto serra. Ma l’idrogeno è un ottimo gas serra, e quindi la fascia abitabile di un pianeta iceano giace a distanze maggiori dalla stella rispetto alla fascia abitabile per un pianeta roccioso con un po’ d’acqua come la Terra. Non è detto quindi che siano tutte rose e fiori.
Odore di mare
In ogni caso, K2-18 b era ora in cima alla lista dei pianeti più interessanti che si potessero studiare. Il fatto che transitasse davanti alla sua stella rendeva possibile la cosiddetta spettroscopia di trasmissione. Funziona così: si osserva la stella prima, durante e dopo il transito del pianeta, e in tal modo possiamo ricostruire come l’atmosfera del pianeta filtra la luce della sua stella. L’imminente lancio del James Webb Space Telescope, che sarebbe stato in grado di fare tale misura, non faceva più stare nella pelle gli astronomi. Si procedette quindi a osservarlo nel 2019 con il telescopio spaziale Hubble, e meraviglia! Ecco davanti ai nostri occhi i segni inconfutabili di un’atmosfera ricca di idrogeno, con alcune tracce di vapore acqueo! Lo scenario iceanico si era fatto molto più concreto.
C’erano però ancora molti asterischi. Per esempio, non è detto che un pianeta con la massa e il raggio di K2-18 b abbia effettivamente un oceano, o più precisamente un’interfaccia gas-liquido. Cioè, potrebbe succedere che l’atmosfera si faccia sempre più densa e calda man mano che si scende in profondità, fino a diventare un gas supercritico indistinguibile dal liquido. In tal caso nell’atmosfera di K2-18 b ci dovrebbero essere anche gas come il metano e l’ammoniaca. Anche un pianeta coperto di lava potrebbe spiegare le osservazioni di Hubble.
Arriva il 2021 e il lancio del JWST. K2-18 b è tra i primi obiettivi del nuovo telescopio spaziale, ed ecco che nel 2023 viene pubblicato il primo studio della sua atmosfera realizzato con questo telescopio. Ed è questo evento a far salire K2-18 b alla luci della ribalta mediatica. Perché l’articolo asserisce di aver confermato la presenza di idrogeno e possibili tracce di acqua, ma nessuna traccia di ammoniaca. In pratica, K2-18 b possiederebbe un oceano chiaramente separato dall’atmosfera.

bianco = idrogeno, grigio = carbonio)
Oltre a queste sostanze ci sarebbero anche metano, anidride carbonica e un gas che attira particolarmente l’attenzione dei ricercatori: il dimetilsolfuro (DMS). Qui sulla Terra il DMS è prodotto dalla biosfera marina e partecipa a creare l’odore del mare, il tipico aroma della salsedine. Il bello però è che non esistono processi inorganici noti che possano produrre DMS nell’atmosfera di un pianeta iceano! Dunque si tratterebbe di una biofirma, una traccia atmosferica della presenza di vita su K2-18 b.
Apriti cielo. Su questa scoperta vengono ricamate ogni genere di notizie, storie, articoli e titoloni, molto spesso utilizzando in modo incauto i termini “abitabile”, “biofirma” o “superterra”. Queste parole evocano nella nostra mente un pianeta come il nostro, con aria respirabile, oceani e tramonti bellissimi. Peccato che in astrofisica significano tutt’altro. E poi come diceva Sagan “per affermazioni straordinarie servono prove straordinarie”, e le prove fornite dal JWST sono tutt’altro che solide. Fin da subito i risultati vengono contestati, come è giusto che sia, da decine e decine di controspiegazioni che descrivono la composizione atmosferica di K2-18 b senza invocare alghe aliene che vivono in acqua a 150 °C e respirano idrogeno.
Lo stato delle cose
Arriviamo quindi al giorno d’oggi e all’articolo recentemente pubblicato, peraltro in forma di bozza non ancora revisionata, su arXiv.org. Gli autori sono gli stessi dell’articolo del 2023 che suggerì la presenza del DMS. Non stupisce dunque che questo nuovo lavoro rinforzi le conclusioni raggiunte due anni fa e anzi aggiunga carne al fuoco. Oltre al DMS ci sarebbe anche il suo fratello più pesante, il dimetil-disolfuro (DMDS), un altro gas biofirma importantissimo.
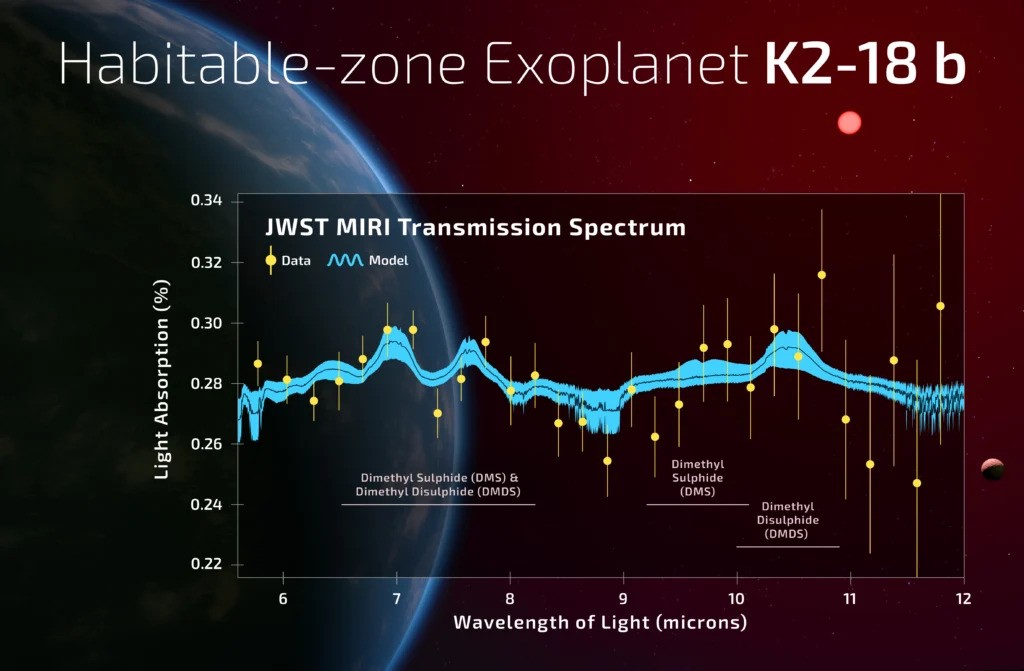
L’articolo è estremamente cauto nella scelta delle parole per descrivere i risultati. Innanzitutto si limita a dire che le osservazioni sarebbero incompatibili con la composizione attesa di un mondo iceanico e basta. Cioè, è conclamato che nell’atmosfera di questo mondo -SE fosse iceanico- ci sono dei gas che non dovrebbero esserci. Questi gas POTREBBERO essere DMS e DMDS, i quali sarebbero presenti con concentrazioni intorno alle 10 parti per milione, 1000 volte più che nell’atmosfera terrestre. Valori tutto sommato alti, fuori equilibrio, che fanno appunto avanzare l’ipotesi della biofirma. Notare i condizionali.
Il problema è che non conosciamo abbastanza bene le loro caratteristiche per esserne certi. Ci sono poi importanti degenerazioni (gergo per dire sovrapposizioni) nello spettro atmosferico ottenuto dal JWST. Cioè, il DMS potrebbe non essere DMS. Potrebbero esserci anche vie inorganiche sconosciute per la produzione di questi gas. L’articolo procede quindi a invocare la realizzazione di studi di laboratorio più avanzati su questi gas – meglio li conosciamo, più saremo bravi a identificarli altrove – e invita alla cautela nell’interpretazione biologica di tale risultati. Per esempio, per fare DMS e DMDS la vita terrestre parte dall’acido solfidrico, H2S, che però nell’atmosfera di K2-18 b è assente.
Non c’è dubbio che la possibile scoperta di DMS e DMDS nell’atmosfera di K2-18 b sia una notizia importante, ma siamo ancora molto lontani da poter fare certe affermazioni. Dare per certa la presenza di vita solo da queste poche informazioni incerte è sbagliato. Questo però non significa che K2-18 b non sia uno degli oggetti più interessanti da studiare a nostra disposizione. Se tutto ciò venisse effettivamente confermato, e serviranno anni di studi e telescopi ancora più avanzati, sarebbe davvero un colpo di fortuna ENORME (e improbabile) aver trovato vita aliena proprio sul primo, e finora unico, pianeta iceano confermato!