014 – Silicio
Il quattordicesimo elemento del Sistema Periodico è il silicio (link alla lettura della scheda), un componente essenziale del pianeta Terra e della tecnologia. Il 28% in massa della crosta terrestre è costituito proprio da silicio, che in combinazione con l’ossigeno genera i silicati.
La somiglianza diagonale
Il silicio si presenta come un solido lucente dai riflessi bluastri, molto fragile e con temperature di fusione ed ebollizione relativamente elevate. Siamo nuovamente di fronte a un caso di somiglianza diagonale, perché queste proprietà fisiche ricordano molto quelle del boro (nel gruppo precedente) piuttosto che quelle dell’elemento soprastante, il carbonio. Il silicio però ha quattro elettroni di valenza, e quindi si comporta come il carbonio, da cui l’intuizione di Mendeleev di metterli nello stesso gruppo.
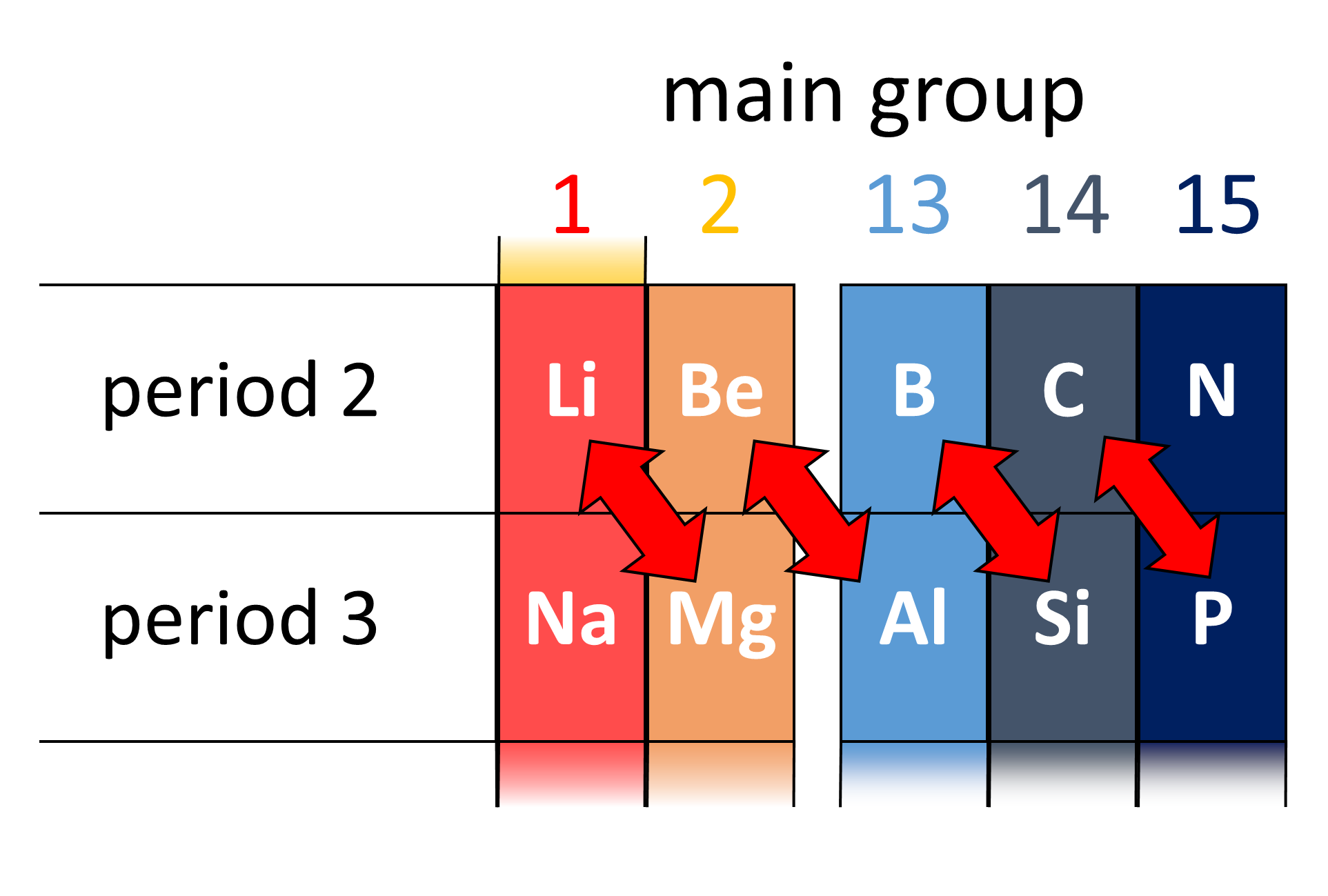
Il fenomeno della somiglianza diagonale merita un approfondimento. Ci troviamo in quell’area della tavola periodica a cavallo tra i metalli e i non-metalli, dove le proprietà chimiche e fisiche cambiano drasticamente tra elementi consecutivi. Tutto dipende, come sempre, da come gli elettroni si dispongono attorno al nucleo, e da come quest’ultimo gli attira a sé. Gli elementi dei primi due periodi hanno nuclei relativamente piccoli, la cui carica positiva viene parzialmente schermata dagli elettroni più interni. Gli elementi del terzo periodo hanno nuclei più grandi e con una carica positiva maggiore, più difficile da schermare. Ecco quindi che serve “un elettrone in più” a generare la stessa schermatura di carica! Per tale motivo gli elementi di periodi diversi tendono a condividere le proprietà fisiche diagonalmente invece che verticalmente.
L’Età del Silicio
Il silicio è veramente ovunque. Il biossido di silicio (SiO2), o silice, costituisce praticamente tutte le rocce del pianeta ed è l’ingrediente principale della lava dei vulcani. Il tenore di silice, e la presenza di gas, determinano quanto un vulcano è esplosivo o effusivo.
La silice è un composto multiforme: in forma pura e cristallina costituisce il quarzo, un minerale secondo solo a diamante e corindone per durezza. Il quarzo finemente sminuzzato è la sabbia silicea, che fusa e formata genera il vetro (un solido amorfo e non cristallino), mentre ancora più fini sono le argille. La silice si trova anche in lunghissimi filamenti: quando è naturale si parla di asbesto (componente principale dell’amianto), quando è artificiale abbiamo invece la fibra di vetro (un isolante termico ed elettrico) e le fibre ottiche. Per non parlare della galassia minerale alla base di cemento, terre refrattarie, ceramiche…

Se si parla di silicio puro, allora la sua importanza aumenta ancora di più. Perché se la silice era la protagonista dell’Età della Pietra, il silicio puro è quello dell’Età del Silicio, l’epoca moderna basata sul microchip. Il silicio è infatti un metalloide o semimetallo; non è né un metallo né un non-metallo. Una sorta di ibrido che vive a metà strada tra i due mondi, come il boro prima di lui. Questo significa che ha una conduttività elettrica che ricorda quella dei metalli, ma solo in certe condizioni (semiconduttore). Ciò permette la realizzazione di dispositivi pazzeschi, come i circuiti integrati e i pannelli fotovoltaici.
Alieni di vetro
Questo elemento viene spesso indicato come un candidato perfetto per generare una biochimica “alternativa”, perché condivide molte proprietà con il carbonio: ibridazione orbitale, tetravalenza, autolegame, lunghe catene. Ma il silicio è un elemento bifronte, e la sua versatilità è ostacolata proprio dalla natura di metalloide che tanto lo rende prezioso per l’informatica. Il nucleo è più grande e gli elettroni sono maggiormente legati ad esso, i legami sono meno forti e l’ibridazione più difficile. Nella chimica del silicio non si riscontra nulla che sia anche solo vagamente comparabile a quella del carbonio. È comunque molto complessa: se la chimica fosse una biblioteca di dieci piani, il carbonio ne occuperebbe nove, e il silicio metà del rimanente.
In ogni caso, è un elemento molto importante in biologia. Molti organismi lo usano per costruire strutture silicee, come le diatomee e i radiolari, ed è essenziale per alcune piante (come il riso). Non ci sono evidenze solide di una sua necessità per l’uomo, ma alcuni lo considerano tra gli elementi essenziali. In forma pura è irritante, ma sono i silicati gli assassini: la polvere di silice causa la silicosi, una malattia professionale dei polmoni incurabile, mentre le fibre di asbesto sono un noto cancerogeno.
Selce, silice e silicone

impurità di ferro trivalente
È chiaro che, data la sua straordinaria abbondanza, l’umanità ha sempre fatto uso e consumo di composti a base di silicio. Dalle gemme (quarzo puro, ametista) ai sassi, dalla sabbia alla malta. L’elemento fu ipotizzato ben prima di essere isolato: Antoine Lavoisier sospettava già nel 1787 che la silice potesse essere l’ossido di un elemento nuovo, e nel 1808 Humphry Davy (ancora lui!) ne coniò il nome. Come per altri elementi, aggiunse la desinenza -ium (tipica dei metalli) al nome dell’ossido, da cui il neolatino silicium. A sua volta, silice deriva dal nome latino della selce, silex, anche usata come pietra focaia. Questa caratteristica la troviamo nel calco fatto da alcune lingue, come il greco che lo chiama piritio (dalla radice per il fuoco, pir-, che si trova anche in pirite).
Qualche anno dopo lo scozzese Thomas Thomson decise invece di aggiungere la desinenza -on, ritenendolo un non metallo come carbonio e boro (in inglese, carbon e boron). L’italiano adottò la versione di Day, silicio, l’inglese quella di Thomson, silicon (che più di un traduttore maldestro ha trasformato in “silicone”). La sua affinità con l’ossigeno è tale che il legame dell’ossido si rivelò difficilissimo da spezzare. Fu finalmente isolato nel 1823 da Berzelius, e si dovettero aspettare altri 31 anni per la produzione di silicio cristallino.
Verso la fine delle stelle
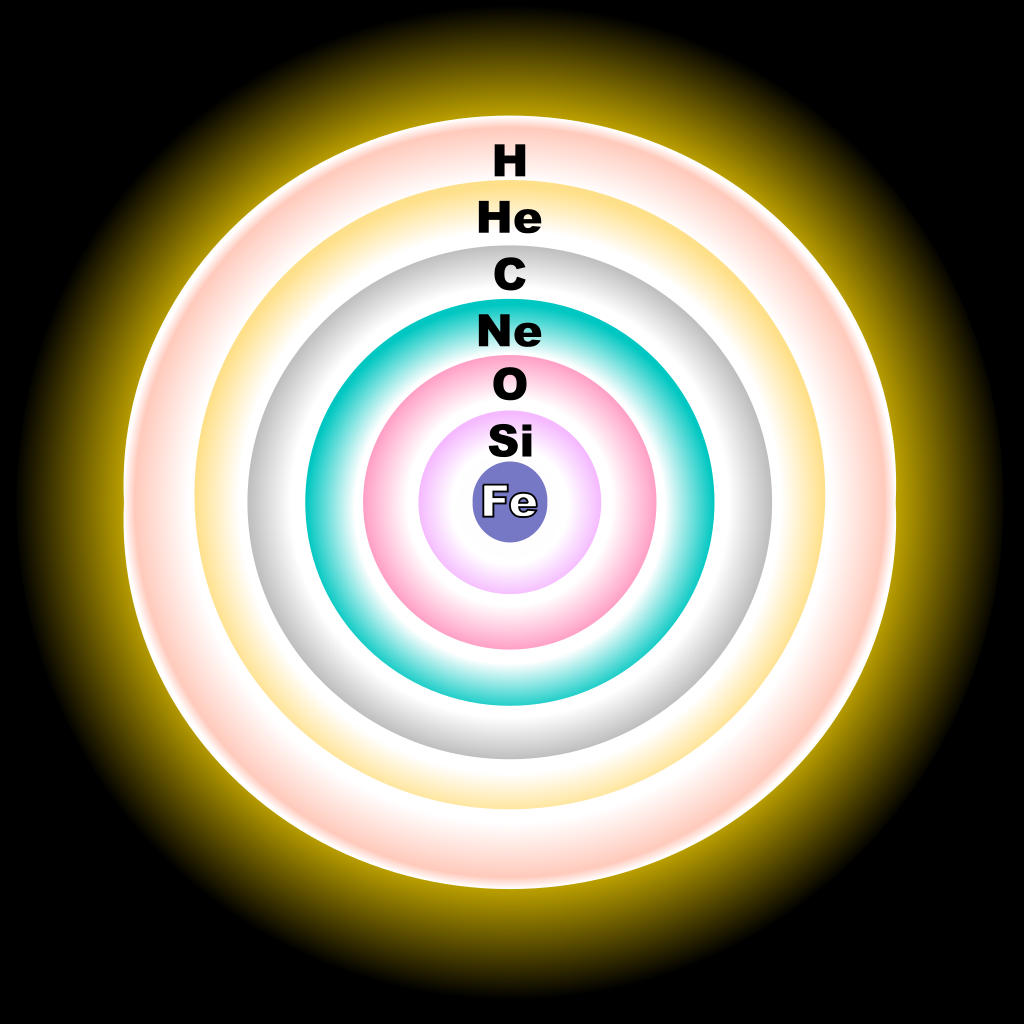
Nell’Universo il silicio è l’ottavo elemento per abbondanza, agli stessi livelli di ferro e magnesio. Ancora una volta, il perché lo troviamo nella nucleosintesi stellare: è un elemento pari prodotto dalla fusione progressiva di particelle α. Nelle stelle anziane ciò avviene durante il penultimo step delle reazioni, quando le grandi quantità di ossigeno prodotte precedentemente (durante il bruciamento dell’elio, del carbonio e infine del neon) vengono finalmente persuase dalle pressioni e temperature a reagire. Il processo consiste nella fusione di due nuclei di 16O, con la produzione energia e un nucleo di 28Si più una particella α rigenerata. Più raramente viene prodotto un nucleo di zolfo, 32S. In una decina d’anni appena, la stella consuma tutto l’ossigeno nel proprio nucleo stellare, e si avvia verso la fase finale: la conversione del silicio in ferro.
Questa è in parte una semplificazione (come già detto con l’ossigeno e il neon), perché in questa fase le reazioni che avvengono sono estremamente complesse e intrecciate. I nuclei si disgregano continuamente sotto l’effetto dell’altissima temperatura, e le particelle α vengono continuamente rigenerate e riaggregate a formare nuclei sempre più pesanti (gli elementi-α). Sarà la supernova infine a disperdere nello spazio i prodotti sintetizzati dalla stella, a cui aggiungerà quelli creati dalla nucleosintesi esplosiva.
La conta degli atomi
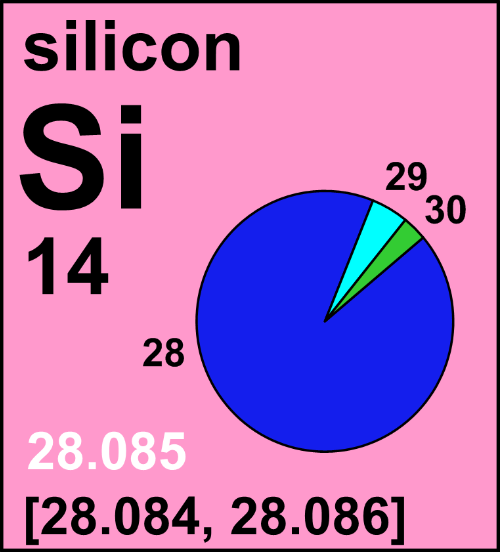
con riportato l’intervallo naturale di variazione
della massa atomica
Il silicio in natura possiede tre isotopi stabili:
1) 28Si (silicio-28), con 14 neutroni: è il prediletto, data la sua natura perfettamente simmetrica da elemento-α, e rappresenta il 92% del silicio naturale. È importantissimo per la scienza: serve silicio-28 purissimo per poter produrre computer quantistici senza difetti, e si è perfino tentato di usarlo per ridefinire il kilogrammo, fino al 2019 vincolato alla massa campione di platino-iridio conservata a Parigi. Ciò sarebbe avvenuto contando gli atomi contenuti in una sfera perfetta di 28Si, e ridefinendo la costante di Avogadro (oggi fissata a esattamente 6,02214076×1023 atomi per mole). Alla fine la spuntò un’altra definizione, basata sul fissare il valore della costante di Planck ed eseguire una misura di corrente con la bilancia di Watt.
2) 29Si (silicio-29), con 15 neutroni: costituisce il 5% del silicio naturale, ed è prodotto dai rami secondari della nucleosintesi che coinvolgono nelle reazioni singoli protoni o neutroni vaganti e successivi decadimenti radioattivi.
3) 30Si (silicio-30), con 16 neutroni: rappresenta il restante 3% ed è anch’esso prodotto in reazioni nucleari molto secondarie.




