Guida all’acquisto del tuo primo telescopio!

Finalmente ecco la guida ufficiale di CHPDB per scegliere e acquistare il tuo primo telescopio! Che sia per fare un regalo a qualcuno di appassionato o per poterti godere il cielo in pace con il tuo primo strumento, qui troverai tutto quello che c’è da sapere per affrontare serenamente il compito e districarsi tra sigle, nomi e parole non proprio famigliari.
L’argomento è vastissimo: esistono discussioni infinite (e anche due live streaming di CHPDB!) dove gli appassionati si danno battaglia per decidere quale sia il telescopio migliore per iniziare a osservare il cielo. Ogni categoria ha i suoi pregi e difetti, e quindi la scelta del modello da acquistare – o regalare – DEVE tener conto dell’utilizzo che si vorrà fare dello strumento.
Prima di iniziare ti diamo subito la cattiva notizia: un telescopio è un oggetto serio, e in ottica la qualità si paga, forse più che in qualsiasi altra disciplina. Appassionati e professionisti amano definire i telescopi molto economici come “hobby killer”, gli ammazza-hobby. Spesso la loro qualità è così bassa e la resa così deludente da sortire l’effetto opposto a quello inteso, allontanando la persona che invece si voleva avvicinare all’astronomia! Di conseguenza se intendi acquistare o regalare uno strumento che dia soddisfazioni a lungo e solletichi “l’appetito” cosmico, allora stai alla larga da qualsiasi cosa sia sotto i 180-200 €. Semplicemente, non vale i tuoi soldi.
Sei di fretta? In fondo all’articolo trovi un riassunto! Inoltre, abbiamo incorporato nella guida i link ad alcuni modelli in vendita su sito dei nostri amici di ArteSky che corrispondono piuttosto bene alle tipologie che descriviamo. Non siamo stati sponsorizzati da nessuna delle marche rappresentate e i modelli sono da intendersi come semplici esempi di configurazione proposta.
L’ABC dell’ottica astronomica
Il telescopio altro non è che un “ricevitore di fotoni”: raccoglie la luce che proviene dai corpi celesti, utilizza specchi o lenti per concentrarla e poi la fa arrivare al nostro occhio. La caratteristica più importante è quindi proprio la sua apertura o diametro. Più è grande più luce sarà in grado di entrare, permettendo quindi di osservare oggetti più deboli.
Un’altra parola chiave è la lunghezza focale, cioè la strada complessiva percorsa dalla luce all’interno dello strumento. Questo valore determina quanto il telescopio è in grado di ingrandire un oggetto, mediante l’utilizzo di un oculare da collocare al termine del percorso ottico della luce – cioè dove si accosta l’occhio.
L’ingrandimento si calcola semplicemente dividendo la lunghezza focale del telescopio per la lunghezza focale dell’oculare. Per fare un esempio: un telescopio “lungo” 400 mm e dotato di un oculare da 10 mm ingrandisce i corpi celesti di 40 volte (400/10=40).
La configurazione ottica
Con questa espressione si intende come è costruito il telescopio e in che modo sono posizionati i suoi elementi. È la configurazione ottica a definire cosa può fare al meglio lo strumento! È quindi questa la prima cosa che bisogna considerare quando si valuta l’acquisto di un telescopio.
Il classicone: il rifrattore

È il telescopio costruito da Galileo Galilei, da lui chiamato “cannone-occhiale”, o cannocchiale. Nella sua forma più semplice possibile la luce viene catturata da una lente frontale chiamata obiettivo che la concentra su un’altra lente, chiamata oculare, dalla quale si compiono le osservazioni. In un telescopio che si rispetti la lente oculare è un oggetto a parte, perché appunto può essere cambiata per modificare gli ingrandimenti prodotti dallo strumento.
I cannocchiali sono i telescopi “entry level” più venduti in assoluto, perché hanno generalmente un ottimo potere di ingrandimento, richiedono pochissima manutenzione e sono facili da trasportare. Tuttavia il loro costo cresce vertiginosamente all’aumentare del diametro, così come l’ingombro!
Questo perché le lenti non rifrangono la luce in modo perfetto. Pensa a un prisma che crea un arcobaleno: colori diversi vengono rifratti ad angoli diversi, causando la scomposizione della luce nei suoi colori. La stessa cosa accade in una lente e quindi un telescopio rifrattore è piagato dalla cosiddetta “aberrazione cromatica”. È impossibile mettere a fuoco tutti i colori nello stesso punto, le immagini avranno sempre un alone colorato fastidioso. Per ovviare al problema si introducono ulteriori lenti di diverso materiale, che si compensano a vicenda minimizzando il difetto. Un telescopio di questo tipo è detto “acromatico”, mentre i top di gamma in grado di rimuovere del tutto l’aberrazione sono i cosiddetti “apocromatici”. Più sono grandi le lenti, più il costo lievita.
Un rifrattore acromatico da 70-90 millimetri di diametro è considerato un ottimo punto di partenza, e forse potresti già fermare qui la tua lettura della guida! I rifrattori sono telescopi molto “lunghi”, e quindi sono indicati per produrre immagini ad elevato ingrandimento. Questa è una caratteristica molto ricercata se si è interessati all’osservazione di oggetti molto piccoli, luminosi e ricchi di dettagli, come i pianeti. Anche le stelle doppie sono soggetti perfetti per questo tipo di strumento. Al contrario, i rifrattori non sono molto adatti a osservare il cosiddetto “cielo profondo”, cioè galassie e nebulose. Si tratta di oggetti ampi, deboli e diffusi che richiedono la raccolta di più luce possibile (grandi aperture), mentre l’ingrandimento è secondario.

Lo strumento perfetto per iniziare con budget ridotto!

Come quello manuale ma si paga la motorizzazione
Il contendente: il riflettore newtoniano

Già Isaac Newton nel 1668, 60 anni dopo Galileo, si era reso conto che i rifrattori di grande diametro diventavano rapidamente enormi, costosissimi e ingestibili. Per questo inventò un telescopio che invece di usare le lenti (all’epoca difficilissime da fabbricare con una qualità e precisione sufficiente) sfrutta la riflessione degli specchi!
Il riflettore newtoniano è semplicissimo: la luce entra nel tubo, si riflette su uno specchio concavo (il primario), torna indietro ma prima di uscire incontra uno specchietto piano angolato di 45° (il secondario), mantenuto vicino all’apertura da una struttura a Y o a X. Il secondario devia lateralmente la luce verso un buco nella parete del tubo, dove si va a posizionare l’oculare.
I riflettori newtoniani sono solitamente più economici dei cannocchiali, tuttavia lo specchio primario va periodicamente ricalibrato, soprattutto se il telescopio viene spostato spesso. Sono più economici perché gli specchi sono molto più facili da costruire delle lenti acromatiche, e quindi si può guadagnare molto in potere di raccolta di luce! Un riflettore newtoniano da 110-130 millimetri di diametro e con 500-900 mm di lunghezza focale* è un ottimo strumento di partenza, che darà sicuramente molte soddisfazioni!
*Attenzione ai telescopi “barlowati”, cioè in cui è stata installata una lente di Barlow non rimuovibile per aumentare artificialmente la focale, a prezzo di una riduzione di qualità delle immagini
I riflettori tendono a essere telescopi piuttosto “corti”, quindi l’ingrandimento non è il loro forte e i dettagli sui pianeti ne risentono. Tuttavia l’elevata superficie di raccolta luce e il campo largo permettono di accedere ai primi oggetti del profondo cielo, come Andromeda, la nebulosa di Orione, gli ammassi globulari e le regioni di formazione stellare. Un particolare modello di newtoniano è quello inventato da John Dobson: il telescopio dobsoniano, che sacrifica ogni extra sull’altare del diametro: anche modelli da oltre 200 mm di diametro hanno costi relativamente contenuti! La lunghezza aggiuntiva del tubo evita il rischio di ritrovarsi con un telescopio “barlowato” e di qualità inferiore.

Uno dei migliori riflettori a basso costo

Per chi può spendere qualcosa in più
Lo zoo dei riflettori
Il mondo dei riflettori però è estremamente vario! Siccome anche gli specchi non sono immuni da difetti e aberrazioni ottiche (aberrazione sferica, coma, astigmatismo…) sono state studiate varie configurazioni che combinano in vario modo specchi piani, parabolici e iperbolici. Tutto dipende da quanto hai di budget e dall’esperienza pregressa di chi riceverà il telescopio! A parità di diametro questi telescopi offrono ingrandimenti maggiori dei newtoniani pur rimanendo molto compatti.

La prima variazione sul tema newtoniano sono i telescopi Cassegrain, nei quali lo specchio secondario riflette la luce del primario attraverso un buco praticato in esso e non verso il lato del tubo. Come detto sono più compatti delle controparti newtoniane, e quindi permettono ingrandimenti maggiori. Solitamente il secondario è iperbolico, permettendo così di correggere l’aberrazione sferica. Se anche il primario viene reso iperbolico allora ecco che si ottiene un telescopio Richtey-Chrétien, libero pure dall’effetto della coma (come il telescopio Hubble). Un ulteriore specchio iperbolico, terziario, produce un riflettore anastigmatico, libero appunto anche dell’astigmatismo. L’esempio più famoso è il telescopio James Webb!
Se invece il percorso ottico di un Cassegrain viene deviato verso il lato del tubo da uno specchio terziario angolato di 45° (come nel newtoniano) si ha un telescopio Nasmyth, mentre se gli assi sono disallineati si ha un telescopio Herschel, e così via. Si tratta di strumenti sempre più complessi (e costosi!), del tutto inadatti agli scopi di questa guida ma che valgono la pena di essere valutati dopo aver fatto un po’ di esperienza e aver capito in che direzione si vuole portare le proprie osservazioni (e portafogli). Dopotutto l’appetito vien mangiando!

Infine, ci sono i riflettori ibridi, o catadiottrici, che fanno uso sia di lenti che di specchi. Sono telescopi estremamente validi in quanto frutto dell’unione del meglio di entrambi i mondi: combinano la praticità degli specchi con la qualità resa possibile dalle lenti. Per esempio l’aggiunta di una lastra correttiva all’imboccatura di un Cassegrain produce un telescopio Schmidt-Cassegrain, molto amato dagli astrofili più esperti.
Un lente diversa produce un’altra variazione sul tema, il telescopio Maksutov-Cassegrain, una delle migliori configurazioni in circolazione e perfetta per l’astrofotografia. Questi telescopi un tempo erano appannaggio dei più esperti, ma recentemente sono entrate sul mercato delle versioni “entry-level” molto interessanti. I Maksutov sono telescopi molto compatti (facili da trasportare) che richiedono poca manutenzione (perché regolati in fabbrica), danno molte soddisfazioni (a occhio e in foto) e sono intuitivi da usare. Possono anche essere abbinati a una bella montatura GoTo (che descriveremo più avanti) per imparare ad esplorare il cielo. Chiaramente, la qualità si paga! Un Maksutov 102/1300 o 127/1500 GoTo è un’ottima scelta se hai un buon budget (400-700 €) e stai cercando qualcosa che valga veramente i tuoi soldi per il tuo primo strumento.

Il Maksutov perfetto per iniziare

Un telescopio più costoso ma che darà soddisfazioni per molto tempo
La montatura
Ottimo, hai scelto il tuo telescopio… ma che differenza c’è tra i vari treppiedi che hai visto negli esempi riportati? Si tratta della montatura e solitamente negli strumenti per principianti è venduta insieme al telescopio. Nulla ti impedisce però di comprare separatemene tubo ottico e montatura! In ogni caso, anche se è inclusa nell’articolo (i cosiddetti “telescopi completi”) è bene avere ben chiaro che cosa si sta andando a comprare!
Il sistema di assi giusto
Una montatura può essere altazimutale o equatoriale. La configurazione della montatura è fondamentale, soprattutto se si vuole utilizzare il telescopio per fare astrofotografia. Diventa un po’ più secondaria invece se si vuole solo osservare. Questo perché la volta celeste è in continua rotazione, e quindi per mantenere un oggetto al centro del campo di vista bisogna inseguirlo! Siccome ogni posizione sulla volta celeste è descritta da due angoli, ogni configurazione permette di ruotare il telescopio attorno a due assi perpendicolari. Per fare ciò l’utente ha delle manopole su cui agire per compiere i vari movimenti.
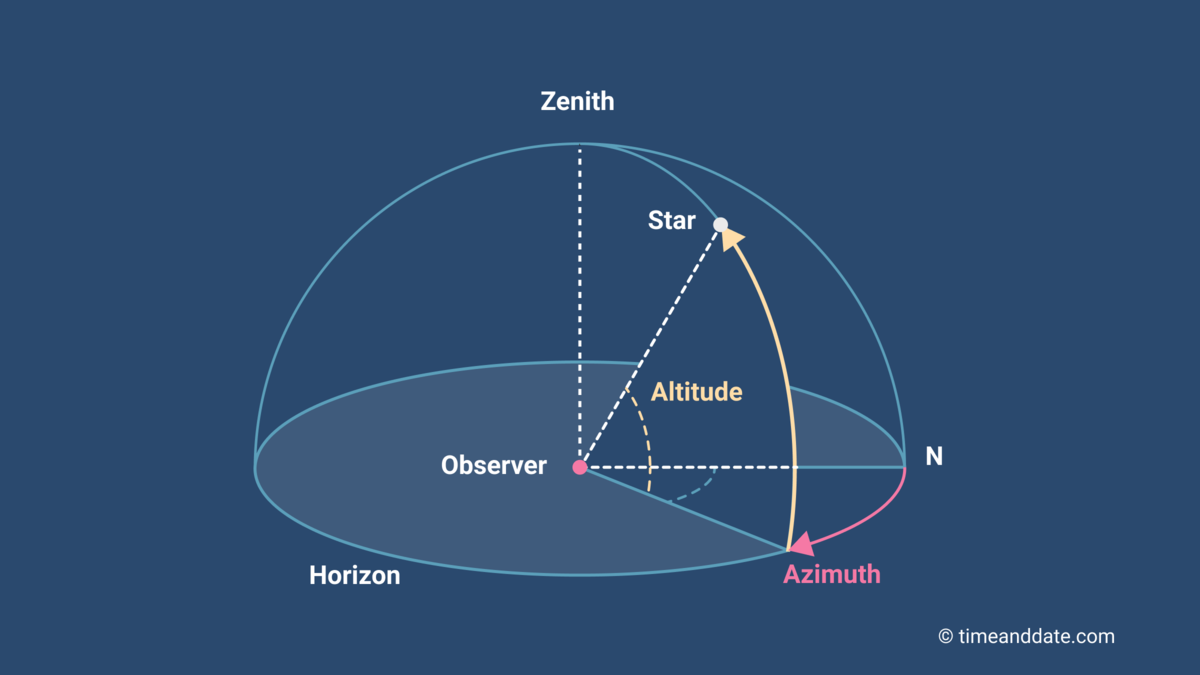
Una montatura altazimutale è la più semplice di tutte. Il telescopio compie una rotazione lungo l’orizzonte (l’angolo di azimut) e l’altra in altezza rispetto l’orizzonte (appunto l’altezza). Meccanicamente è semplice, quindi costa poco. È la montatura che rende possibile il dobsoniano: in tal caso non c’è nemmeno il treppiede, è solo uno specchio dotato di tubo che si orienta in altezza e azimut come un cannone. Di conseguenza i dobsoniani sono i telescopi che permettono (a parità di prezzo) di ottenere gli specchi più grandi possibili. L’inseguimento è un po’ macchinoso, perché bisogna operare entrambi gli assi di rotazione, ma ci si abitua in fretta. A causa di questo non è molto indicata se si ha intenzione di fare fotografia.
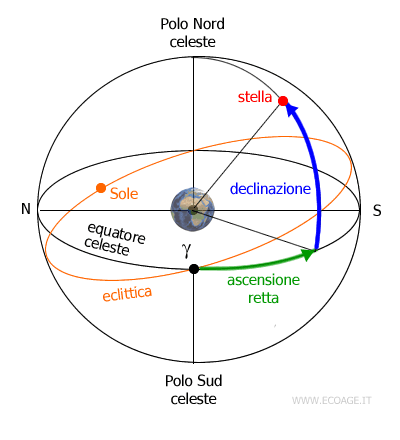
Una montatura equatoriale invece, come suggerisce il nome, permette di allineare il telescopio all’equatore celeste e non all’orizzonte locale. Sono due movimenti diversi: in declinazione (la distanza angolare dal Polo Nord celeste, come la latitudine) e in ascensione retta (come la longitudine). Siccome la volta celeste appare ruotare attorno al Polo Nord celeste allora diventa molto semplice inseguire un oggetto, perché basta agire solo sull’ascensione retta.
Tale capacità la rende anche molto indicata se si vuole fare astrofotografia, ma chiaramente bisogna essere disposti a pagare un prezzo leggermente maggiore. Una montatura equatoriale ha bisogno di essere allineata all’asse di rotazione terrestre per funzionare correttamente, e questo non è facile per un neofita. L’altazimutale al contrario non necessita di allineamento.
Motore o non motore?
Le montature possono essere manuali (come descritto finora) o motorizzate. In generale tutti i telescopi per principianti sono dotati di montature manuali, e che siano equatoriali o altazimutali cambia veramente poco per l’utente. Se però si vuole evitare di dover agire manualmente sulle regolazioni durante l’osservazione è possibile acquistare dei sistemi dotati di motore. In generale si trovano quasi esclusivamente sulle montature equatoriali, e perché siano efficaci è vitale allineare correttamente la montatura all’asse di rotazione terrestre. L’esecuzione di lunghe pose fotografiche richiede imprescindibilmente una montatura equatoriale motorizzata. Se già una montatura equatoriale di base è più costosa di una altazimutale, ecco che il prezzo esplode se la si vuole con inseguimento motorizzato – più è grande il telescopio, più sarà pesante il tubo ottico, più potente e preciso dovrà essere il motore!
Un tipo di motorizzazione totalmente diversa che si trova sia sulle equatoriali che sulle altazimutali è il “GoTo“, cioè il “vai a”. Si tratta di un computer in grado di puntare autonomamente il telescopio. È la soluzione perfetta per chi è completamente a digiuno di astronomia e vuole il telescopio solo come svago per osservare questo o quell’oggetto. Attenzione però, perché ciò viene a un prezzo significativamente superiore. Inoltre, anche una montatura GoTo deve essere allineata per funzionare correttamente, un compito non immediato. Normalmente ciò avviene puntando a mano tre o quattro stelle molto luminose indicate dal computer, dalle quali il sistema capisce come è orientato. Dopodiché basta digitare nella pulsantiera le coordinate o il nome dell’oggetto e il computer di bordo punterà automaticamente.
I telescopi “smart”
Negli ultimi anni c’è stato l’avvento di una nuova tipologia di telescopi introduttivi al mondo dell’astronomia, che fa uso dell’enorme potenzialità rappresentata dagli smartphone. Si tratta di strumenti introduttivi semplici (come un rifrattore 90/900 o un riflettore 127/1000) dotati però di un sistema per ancorare il telefono alla montatura del telescopio. Insieme al telescopio si acquista anche un’app speciale da installare sullo smartphone, che permette di guidare l’utente tanto nelle osservazioni quanto nelle operazioni di allineamento.
In pratica è come una montatura GoTo – è in grado di capire dove sta puntando il telescopio grazie a un allineamento iniziale fatto con le stelle più luminose – ma senza la costosa motorizzazione elettronica, in quanto è tutto manuale. Questo permette anche di avere a disposizione cataloghi veramente immensi, con moltissime funzionalità. Un telescopio di questo tipo potrebbe essere un ottimo primo passo nel mondo dell’astronomia, se si è disposti a pagare il valore aggiuntivo di questo sistema guidato!

Forse lo strumento perfetto per iniziare!

Esiste anche la versione senza barlow ma più costosa
Gli oculari
Infine, non bisogna sottovalutare la qualità del componente che viene messo all’altro estremo del telescopio e che rende possibile non solo l’osservazione ma anche la scelta dell’ingrandimento dell’immagine. Anche in questo caso la gran parte dei telescopi completi per neofiti sono venduti con una dotazione standard di un paio di oculari, per avere due livelli di ingrandimento. Solitamente quindi non sono una preoccupazione per chi sta acquistando uno strumento introduttivo, almeno se si rimane nel budget che ti abbiamo indicato a inizio articolo. Sotto a quella cifra diventa via via più probabile che gli oculari in dotazione al tuo acquisto siano poco più che pezzi di vetro!
Solitamente l’acquisto di oculari di qualità maggiore rispetto a quelli base che vengono impacchettati nelle offerte introduttive è la prima “voglia” che viene dopo aver iniziato a osservare il cielo. Un oculare di qualità può tirare fuori il meglio anche da uno strumento più scadente e soprattutto può essere riutilizzato anche in futuro quando e se si deciderà di affrontare l’acquisto di un telescopio più avanzato. In tal senso potrebbe essere un ottimo regalo per qualcuno che ha già il suo primo strumento ma che magari non lo sta sfruttando al massimo (dai un’occhiata al suo parco oculari prima però, per non avere doppioni!). Un oculare grandangolare è perfetto per il profondo cielo, perché permette di aumentare molto il campo di vista del telescopio regalando un’esperienza completamente nuova senza cambiare strumento. Invece un oculare a focale corta permette di aumentare molto gli ingrandimenti, dando molte soddisfazioni nell’osservazione dei pianeti.
In conclusione
Riassumendo, per il primo telescopio devi chiederti quanto vuoi spendere e come verrà usato lo strumento.
- Se vuoi osservare nebulose e galassie ti serve uno strumento che abbia una grande capacità di raccolta luce. Scegli un newtoniano da 114-127 mm di diametro e 500-900 mm di focale. Attenzione alla “febbre da apertura”, perché ti verrà subito voglia di comprare specchi più grandi!
- Se vuoi osservare i pianeti allora ti serve uno strumento che sia in grado di ingrandire molto. Scegli un rifrattore da 70-90 mm di diametro e almeno 900 mm di focale. I rifrattori di qualità costano di più ma “invecchiano” come esperienza più lentamente dei riflettori.
- Se vuoi unire il meglio dei due mondi e hai un ottimo budget allora scegli un Maksutov da 102-127 mm di diametro e 1200/1500 mm di focale, è uno strumento che ti durerà molto a lungo.
- Se vuoi imparare facilmente le basi guidato da un computer per allineamento e puntamento ma non vuoi affrontare l’acquisto di una GoTo allora i telescopi “smart” (come i Celestron “Starsense”) fanno al caso tuo. Ce ne sono di tutti i gusti!
- Se vuoi fare osservazione visuale allora molti orpelli non ti servono. Basta una montatura altazimutale e, se te lo puoi permettere, una motorizzazione GoTo. Dipende anche quanto hai voglia di “fare gavetta” e imparare a usare un telescopio in modo puramente manuale. In tal senso un dobsoniano da 150-200 mm di diametro potrebbe essere ciò che cerchi.
- Se vuoi fare fotografia, apri il portafoglio! Ti servono sicuramente una montatura motorizzata e un telescopio in grado di reggere il compito, e quindi di qualità. L’introduzione all’astrofotografia è di là di questa guida (c’è un bellissimo libro di Luca Fornaciari in merito!), ma che qualunque associazione astrofili sarà ben contenta di mostrarti e spiegarti.
- Se il telescopio ce l’hai ma ti sembra che non venga sfruttato al meglio, valuta l’acquisto di un bell’oculare da aggiungere alla tua collezione!



Posso proporre un percorso molto alternativo?
supponendo che in casa ci siano un pc e e una macchina fotografica ¨seria”, reflex o mirrorless:
– passo uno giocare con skychart! costo zero!
– passo due fare foto a campi larghi per vadere dal vero cosa si e’visto con skychart ! costo zero.
– passo tre! Provare a inseguire con la macchina fotografica e gli obiettivi, con una piccola montatura o con l’astrotracer se avete una Pentax (e se non l´avete una k5 usata e un gps costano circa 400/500 euro, ma se poi rinunciate all’astrotografia avete comunque comprato una buona macchina fotografica)
Io sconsiglio un astroinseguitore perche é’una strada ¨chiusa” : una eq5 usata costa piu’o meno lo stesso, pero’se poi il gioco vi piace regge anche un telescopio…