008 – Ossigeno
L’ottavo elemento del Sistema Periodico ci riporta nel podio degli elementi più abbondanti dell’Universo. Ecco dunque, al terzo posto, l’ossigeno! (link alla lettura della scheda). Le stelle sono così brave a produrlo che oggi costituisce l’1% della massa del Cosmo, mentre tutti gli altri fanno il resto.
Se idrogeno ed elio sono gli elementi delle stelle, l’ossigeno è l’elemento dei pianeti. Quando si considera la composizione della Terra, l’ossigeno rappresenta il 30% della massa planetaria e il 46% della crosta. Quasi tutto è contenuto nelle rocce, con una piccolissima parte nell’acqua del pianeta. Sembra che ce ne sia molta, ma la massa dell’acqua terrestre è appena lo 0,02% del totale, e si trova per il 96% negli oceani. Questo suo ruolo è ben riassunto anche nel nome che viene dato al gruppo di elementi di cui l’ossigeno è capostipite: i calcogeni, dal greco khalkόs–genēs ovvero i creatori di minerali.
Quella poca acqua è però fondamentale: il 65% del peso di un essere umano è ossigeno, e grazie alla fotosintesi clorofilliana il 21% del volume atmosferico è ossigeno molecolare, O2.

Un elemento focoso
L’ossigeno è il sesto elemento del secondo periodo, ed è pertanto dotato di sei elettroni. Il nuovo arrivato va a completare il primo dei tre orbitali 2p, e questo rompe la simmetria dell’azoto. Questo elemento ha due elettroni spaiati, ed è quindi disperatamente alla ricerca di altri due che gli permettano di completare il suo “ottetto”. Ciò significa che l’ossigeno è molto reattivo, solo il fluoro gli è superiore. Questo è ben rappresentato dalla sua elettronegatività, a quota 3,44.
È così reattivo che praticamente ogni materiale messo a contatto con l’ossigeno puro prende fuoco. Un comportamento così emblematico che ogni qual volta un elemento perde degli elettroni a favore di un altro si parla di ossidazione e il ladro è chiamato ossidante, anche se non c’è ossigeno coinvolto. La combustione e la corrosione sono reazioni di ossidazione, la prima rapida e la seconda molto più lenta.
La molecola di ossigeno biatomico ha una caratteristica peculiare: ha un doppio legame, ma due elettroni rimangono non appaiati. Questo rende la molecola di ossigeno una sostanza paramagnetica (attratta dai campi magnetici) dal colore azzurro, specialmente nella forma liquida e solida.
Ossigeno triatomico: l’ozono
L’ossigeno ha un’altra forma allotropica, costituita da tre atomi legati a triangolo: l’ozono (O3). Questa molecola si forma in alta stratosfera, dove la radiazione ultravioletta del Sole può spezzare le molecole di ossigeno. Gli atomi liberati interagiscono immediatamente con un’altra molecola di ossigeno biatomico, creando l’ozono. È una sostanza opaca all’ultravioletto, che va a generare uno schermo naturale a protezione della superficie del pianeta dalla radiazione UV solare più violenta. L’ozono è però un gas arrabbiato, estremamente reattivo e irritante per le mucose, che può formarsi anche a livello del suolo! Ciò avviene specialmente durante le giornate molto soleggiate o a causa della caduta di fulmini. Il suo tipico odore agliato è infatti un classico precursore dei temporali estivi.
Il creatore di acidi
La storia di questo elemento è peculiare, tanto che non esiste un singolo scopritore. Che nell’aria ci fosse qualcosa in grado di corrodere i metalli era chiaro già agli antichi, come Filone da Bisanzio, e persino Leonardo da Vinci osservò che “una porzione di aria” scompare durante la combustione e la respirazione. L’elemento era stato prodotto puro già all’inizio del 1600, ma non fu riconosciuto come tale a causa della diffusione della teoria del flogisto. In essa si sosteneva che i combustibili fossero fatti da due parti: il flogisto, che si liberava nella combustione, e la calce, che rimaneva indietro. L’aria non recitava alcuna parte.
La teoria del flogisto venne confutata nel 1777 da Antoine Lavoisier, grazie ai suoi esperimenti sulla combustione. Le conclusioni raggiunte confermarono che il gas isolato da Carl Scheele nel 1772 e Joseph Priestley nel 1774 era appunto un nuovo elemento! Lavoisier lo battezzò oxygène, dal greco per “acido” (oxys) e “creatore” (-genēs), in quanto imputava la forte azione corrosiva degli acidi alla presenza di questo elemento. Non è proprio così, ma il nome è rimasto. Da esso discendono tutte le parole già viste, e le calci della teoria del flogisto divennero quindi gli ossidi.
Ceneri termonucleari
L’ossigeno è così abbondante perché ha un nucleo particolarmente stabile e molte vie di sintesi nelle stelle. La nucleosintesi del carbonio, il primo step dopo l’elio, produce infatti anche una porzione di ossigeno, e questo porta le stelle giganti a sviluppare un nucleo stellare di carbonio-ossigeno. Quando la stella muore, il suo nucleo diventa una nana bianca C-O. Se la stella è abbastanza massiccia accede invece allo step successivo, che trasforma il carbonio in ossigeno, neon e magnesio. Ancora una volta si forma un nucleo stellare con tale composizione, che rimane invariata alla morte della stella producendo una rara nana bianca O-Ne-Mg. Stelle ancora più grandi possono infine fondere il neon, che si trasforma in ossigeno e magnesio.
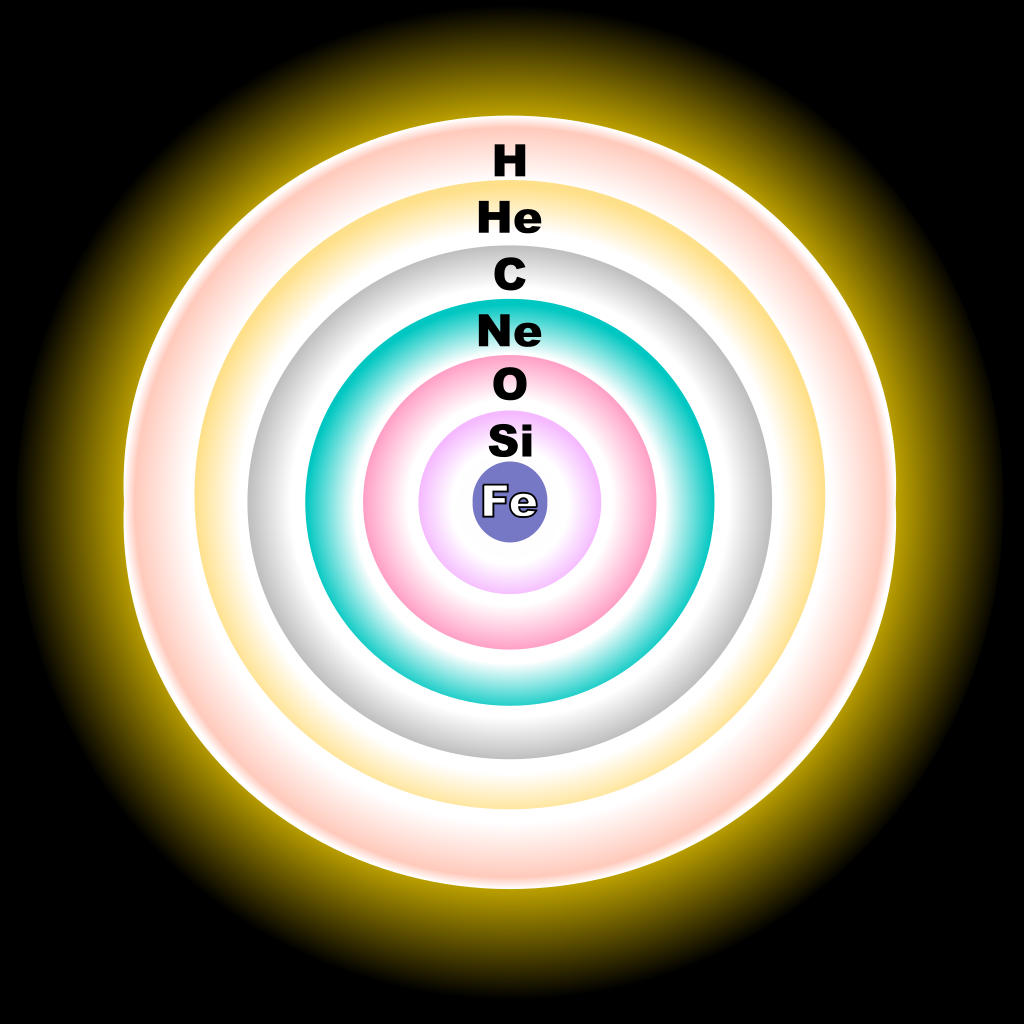
Tutto questo ossigeno è però sequestrato per sempre. Le nane bianche sono cadaveri stellari ultradensi che rimangono tali fino alla fine dei tempi, mentre i nuclei delle stelle più massicce sono destinati a venire convertiti in ferro dagli step successivi. L’ossigeno che respiriamo arriva da un processo ben diverso: la supernova.
Quando una stella molto massiccia giunge alla fine della sua vita è fatta a strati, all’interno dei quali avvengono i vari step della nucleosintesi stellare. Al termine di questa catena di reazioni si forma un nucleo stellare fatto di ferro, e siccome questo è l’elemento più stabile dell’Universo non si può andare oltre. Il nucleo della stella collassa (diventanto stella di neutroni o buco nero!), la stella implode, lo colpisce, e rincula catastroficamente. Nella detonazione vengono sintetizzate grandissime quantità di elementi tra l’elio e il ferro, tra cui l’ossigeno. Si può dire che ogni respiro sia una boccata di supernova vecchia di miliardi di anni!
A pieni polmoni
Per la vita terrestre l’ossigeno è vitale in due modi: partecipa alla biochimica delle proteine, ma prima di ciò è il fulcro stesso del metabolismo. Gli organismi autotrofi catturano l’energia del Sole, e convertono anidride carbonica e acqua in ossigeno e carboidrati. Gli eterotrofi fanno il contrario: inspirano ossigeno e lo usano per bruciare i carboidrati, ottenendo l’energia in essi immagazzinata. Anche la respirazione è dunque una reazione di combustione, che avviene a livello cellulare!

durante l’evento della Grande Ossigenazione
Non fu sempre così però. Le prime forme di vita terrestri erano anaerobe, ovvero non necessitavano di ossigeno. Poi però, 3,5 miliardi di anni fa, i cianobatteri inventarono la fotosintesi, una tecnica che libera ossigeno! Ciò causò la peggiore catastrofe planetaria dopo la formazione della Luna. Inizialmente si ossidarono le sostanze sospese nelle acque del mare, poi l’ossigeno cominciò ad accumularsi in atmosfera.
E l’ossigeno è un veleno mortale per gli organismi anaerobi. Ecco la prima grande estinzione di massa della storia: il grande evento ossidativo o catastrofe dell’ossigeno, 2,4 miliardi di anni fa. Il 99% delle forme di vita furono spazzate via, ma chi sopravvisse prosperò e questo gas si accumulò fino a raggiungere il valore odierno
L’ossigeno molecolare è comunque una sostanza estremamente reattiva. È totalmente fuori dall’equilibrio chimico della Terra: se la fotosintesi smettesse di produrlo nel giro di 2.000 tornerebbe a far parte del mondo minerale. Ciò significa che un’abbondanza di ossigeno nell’atmosfera di un esopianeta potrebbe essere considerata un forte indizio della presenza di vita aliena!
I gusti dell’ossigeno
L’ossigeno in natura possiede tre isotopi stabili.

con riportato l’intervallo naturale di variazione
della massa atomica
1) 16O (ossigeno-16), con 8 neutroni: è l’isotopo più comune, costituendo il 99,76% del totale. Data la sua fantastica simmetria è favorito nella nucleosintesi stellare, e quindi è lui a dominare.
2) 17O (ossigeno-17), con 9 neutroni: è il più raro, pari allo 0,04% del totale. È un sottoprodotto di alcune catene di nucleosintesi, principalmente il ciclo CNO. Si tratta di un isotopo asimmetrico e dispari, e ciò lo rende perfetto per la risonanza magnetica nucleare per lo studio dei percorsi metabolici.
3) 18O (ossigeno-18), con 10 neutroni: costituisce il rimanente 0,2% ed è generato quando un nucleo di 14N assorbe una particella α e decade in 18O. È importantissimo per la paleoclimatologia! Una molecola d’acqua contenente 18O è infatti più pesante di una con 16O, e questo incide sulla sua capacità di evaporare dalla superficie del mare. Questo a sua volta influenza la composizione isotopica delle precipitazioni. Mari più caldi facilitano l’evaporazione di questa acqua più pesante, e viceversa. Analizzando il rapporto tra 16O e 18O nel ghiaccio dell’Antartide è quindi possibile ricostruire le temperature fino a 800.000 anni fa, e questo intervallo temporale può diventare di centinaia di milioni di anni analizzando i fossili.




