L’Overshoot Day 2022 è il più precoce di sempre

Il 28 luglio cade l’Earth Overshoot Day per l’anno 2022. L’Overshoot Day mondiale è il giorno, calcolato dall’associazione Global Footprint Network, in cui l’umanità ha consumato l’intero budget di risorse che la Terra riesce a mettere a disposizione in un anno. Da oggi, quindi, siamo in debito con il nostro pianeta; da domani cominceremo a consumare le risorse terrestri del 2023.
Un preoccupante trend negativo
Un debito, quello nei confronti del nostro pianeta, che stiamo continuando ad accumulare dal 1971, il primo anno in cui l’umanità ha cominciato a richiedere al pianeta risorse (terreni fertili, acqua potabile, aria pulita, fonti di energia ecc.) più rapidamente di quanto quest’ultimo sia in grado di generarne.
Con lo sviluppo sociale, economico e tecnologico, la situazione nei decenni è andata progressivamente peggiorando: l’Overshoot Day mondiale è arretrato di ben cinque mesi nell’ultimo mezzo secolo.
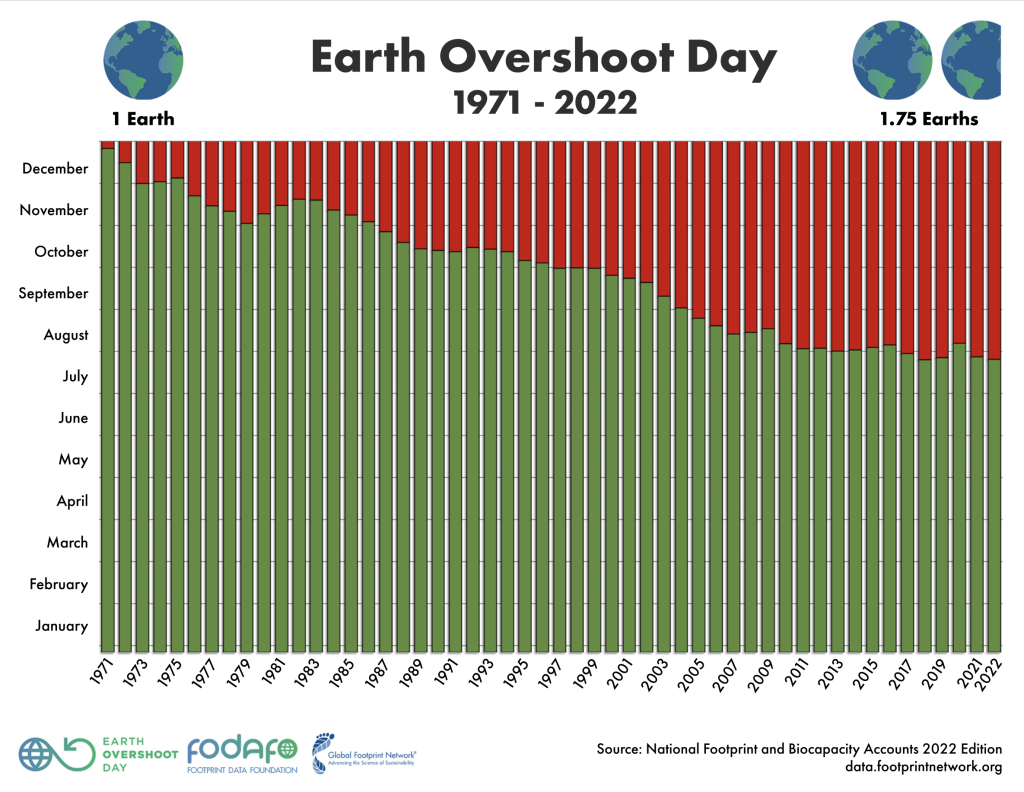
L’Overshoot Day più precoce di sempre, purtroppo, è proprio quello di quest’anno (a pari merito con il 2018). Per trovare il precedente record negativo basta risalire soltanto allo scorso anno. Nel 2021, come nel 2019, l’Overshoot Day è caduto il 29 luglio.
Un’altra indicazione della sempre maggiore insostenibilità del nostro sfruttamento delle risorse terrestri arriva dal fatto che tutti e quattro gli Overshoot Day caduti a luglio risalgono agli ultimi cinque anni. Fa eccezione il 2020 unicamente per via delle chiusure globali istituite durante la prima ondata della pandemia di COVID-19, ma già il 2021 ha ripreso il “business as usual” e quest’anno siamo riusciti a fare ancora peggio e bissare il record assoluto.
Che cosa significa tutto questo
La Global Footprint Network calcola la data dell’Overshoot Day in base al concetto di ettaro equivalente. Sostanzialmente si misura quanti ettari sono necessari per produrre tutte le risorse che l’umanità consuma in un anno, e si confronta con gli ettari effettivamente a disposizione (la cosiddetta biocapacità globale). È in base a questo rapporto che si calcola la data dell’Overshoot Day.
Dai calcoli risulta che nostro attuale ritmo di consumo abbiamo bisogno di 1,75 Terre per mantenere il nostro tenore di vita senza andare in debito con il nostro pianeta.
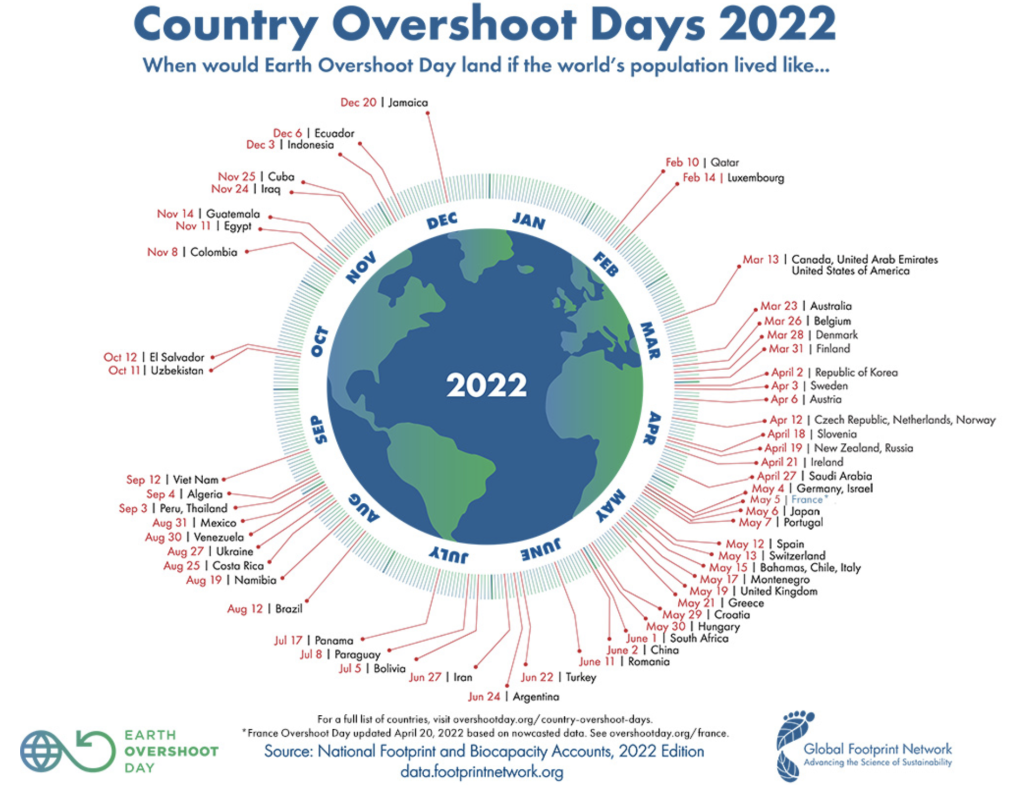
Questo è un valore medio per tutti i Paesi. E l’Italia? Il nostro Overshoot Day quest’anno è caduto il 15 maggio. Significa che se tutti nel mondo mantenessero il nostro tenore di vita, l’umanità avrebbe bisogno di ben 2,7 Terre.
Su scala ancora più piccola, qui è possibile calcolare la propria impronta ecologica individuale.
Che cosa possiamo fare?
La stessa Global Footprint Network propone in una sezione del suo sito le possibili soluzioni a quello che è evidentemente un problema globale. La bottomline è molto chiara: oltre la metà della nostra impronta ecologica deriva dall’uso dei combustibili fossili. Dimezzandone il consumo l’Earth Overshoot Day slitterebbe in avanti di oltre tre mesi.
Guadagneremo un altro mese abbondante evitando gli sprechi alimentari e riducendo il consumo di carne: il cibo da solo consuma metà della biocapacità terrestre. In Italia, per esempio, ogni caloria che ingeriamo da carne o pesce richiede il consumo di 10-11 calorie provenienti da combustibili fossili. Poi ci sono i trasporti: soltanto dimezzando l’uso dell’auto l’Overshoot Day avanzerebbe di 13 giorni. Riforestare 350 milioni di ettari rimanderebbe il nostro debito di altri 8 giorni.
Le strategie, per quanto drastiche, ci sono. E sono le stesse necessarie per farci evitare nei prossimi decenni le catastrofiche conseguenze di un riscaldamento globale incontrollato. Basta spostare la data in avanti di 5 giorni all’anno per rimetterci in pari con il pianeta entro la metà del secolo.
Non abbiamo più scuse. Dobbiamo agire subito, e chiedere ai nostri rappresentanti di spostare in avanti il più possibile questa data. Non abbiamo 1,75 Terre: ne abbiamo una soltanto, e non la stiamo trattando per niente bene.



